Suyun İyonlaşması
Saf su çok az da olsa iyonlaşır. Suyun iyonlaşma denklemi,
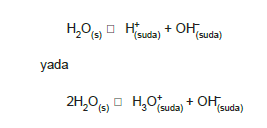
Reaksiyon denge tepkimesi olduğu için denge sabiti K = [H+] [OH] şeklinde olur.
Tepkimenin denge sabiti 25°C sıcaklık ve 1 atm basınç altında 10–14 olarak bulunmuştur.
Ksu = [H ] [OH ]
K = 1.10–14
1.10–14 = [H+] [OH–]
Nötr çözeltide H+ ve OH– iyonlarının derişimi birbirine eşittir.
[H+] = [OH–] = 10–7 mol/L
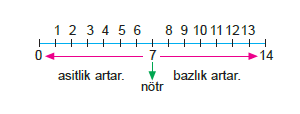
[H+] > 10–7M ise ortom asidik
[H+] = 10–7M ise ortam nötr
[H+] < 10–7M ise ortam bazikti
pH ve pOH Kavramı
Bir çözeltide H+ iyonlarının derişiminin eksi logaritmasına pH denir.
pH = –log [H+]
Bir çözeltide OH– iyonlarının derişiminin eksi lograritma- sına pOH denir.
pOH = –log [OH–]
Sulu çözeltide pH + pOH = 14 tür. [H+] derişimi arttıkça pH küçülür.
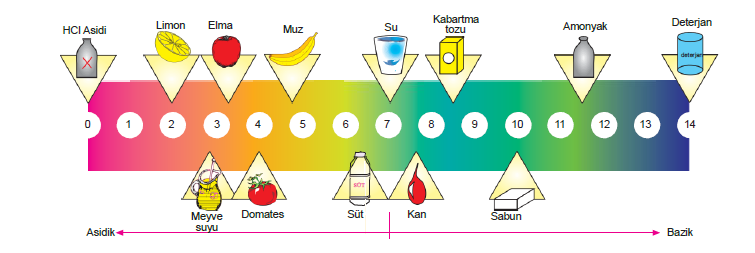
pH skalası


[kimya_ygs_lys]
