Elektroliz

Kendiliğinden gerçekleşmeyen redoks tepkimelerinin dışardan elektrik enerjisi verilerek oluşturulmasına elektroliz denir.Elektrolizde kullanılan elektrik akımını ileten çözeltilere elektrolit denir. (Asit, baz, tuz çözeltileri) Elektrolitlerin içine Pt, Cu, Ag, Au gibi elektrotlar batırılır. Elektrik enerjisi doğru akım kaynağı (pil) ile sağlanır. Pilin (+) kutbuna bağlı elektrot anot, (–) kutbuna bağlı elektrot katottur. Katotda indirgenme, anotta yükseltgenme olur. Katyonlar katotta indirgenir, anyonlar anotta yükseltgenir.
Erimiş Tuzların Elektrolizi
Erimiş NaCl elektrolizinde ortamda Na+ ve Cl– iyonları bulunur. Na+ iyonları katotta indirgenir. Cl– iyonları anotta yükseltgenir.
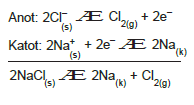
Katotta 2 mol Na toplanır. Anotta 1 mol Cl2 gazı açığa çıkar.
- Elektroliz kabında birden fazla çeşit katyon varsa, indirgenme potansiyeli büyük olan ilk önce indirgenir.
- Elekroliz kabında birden fazla çeşit anyon varsa yükseltgenme potansiyeli büyük olan ilk olarak yükseltgenir.
Sulu Çözeltilerin Elektrolizi
Sulu çözeltilerde tuzdan gelen iyonların yanında, kısmen iyonlaşan sudan, H+ ve OH– iyonları gelir.
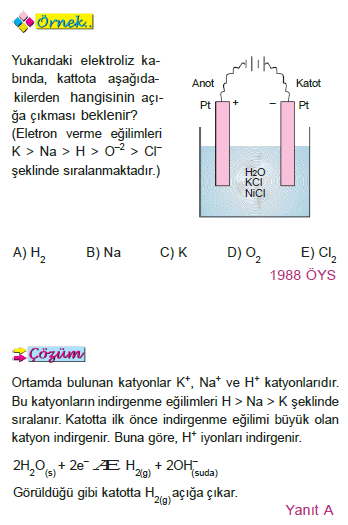
Örnek
KBr Sulu Çözeltisinin Elekrolizi
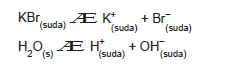
Ortamda K+ ve H+ katyonları, Br– ve OH– anyonları bulunur.
Elektron verme eğilimleri K > H > Br– > OH– şeklindedir.
Buna göre K+ ve H+ katyonlarından indirgenme eğilimi büyük olan H+ indirgenir. Br– ve OH– anyonlarından yükseltgenme eğilimi büyük olan Br– yükseltgenir.
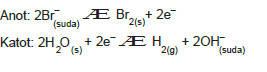
Anotta Br2(s) katotta, H2(g)açığa çıkar. OH– derişimi arttığı için çözelti bazik olur. pH artar.
Faraday Yasaları
Elektroliz devresinde açığa çıkan madde miktarı devreden geçen yük miktarı ile doğru orantılıdır.
Q = I.t Q : Yük miktarı
I : Akım şiddeti(amper)
t : zaman(saniye)
Elektroliz devresinden 1 faradaylık akım (96500 kulon = 1 mol elektron yükü) geçtiğinde elektrotlarda 1 eşdeğer gram madde açığa çıkar.
Elektotlarda toplanan madde miktarı
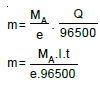
eşitliği bulunur.
m = Toplanan madde miktarı (g)
I = Akım şiddeti (amper)
t = Zaman (saniye)
Ma = Mol kütlesi (g/mol)
e = Etki (tesir) değerliği
ÖRNEK: 1 faraday elektrik yükü için,
I. 1 mol elektronun yüküdür.
II. 96500 kulan (coulomb) dur.
III. CuSO4 çözeltisinden 1 mol Cu açığa çıkaran elektrik akımıdır.
tanımlarından hangileri doğrudur?
A) Yalnız I B) Yalnız II C) Yalnız III D) I ve II E) I, II ve III
1995 ÖYS
ÇÖZÜM: 1 faradaylık elektrik yükü 1 mol elektronun yüküdür ve 965000 kulondur.
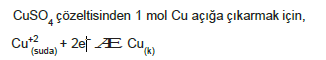
2 mol elektron yükü, 2 faraday elektrik yükü gerekir. 1 faraday elektrik yükü 0,5 mol Cu açığa çıkarabilir.
Yanıt D
- Seri bağlı elektroliz kaplarında aynı miktarda elektrik akımı aynı süreyle geçer. Seri bağlı elektroliz kaplarında elektroliz edilen iki maddenin toplanan kütleri arasında aşağıdaki oran vardır.
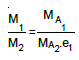
[kimya_ygs_lys]
