Asit ve Baz Dengesi
Asit – Baz Tanımları
1. Arhenius Tanımı
Suda iyonlaştıklarında ortama H+ iyonu veren maddeler asit, OH– iyonu veren maddeler bazdır
Örnerğin, HNO3, HCI, HF, CH3COOH gibi maddeler su- da iyonlarına ayrıştığında, aşağıdaki denklemlere göre, H+ iyonu verirler.
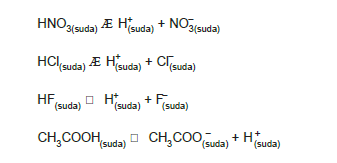
NaOH, Ba(OH)2 gibi maddeler suda iyonlaştıklarında
OH– iyonu verdikleri için bazdırlar
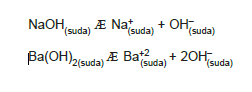
Arhenius tanımı bazı maddelerin asit veya baz olduğunu açıklamak için yetersiz kalmaktadır. Örneğin yapısında H+ iyonu bulunmadığı halde AlCl3 asittir. Yapısında OH– iyonu bulunmadığı halde NH3 bazdır.
2. Bronsted – Lowry Asit – Baz Tanımı
Bu tanıma göre proton (H+) alabilen maddeler baz, pro- ton (H+) veren maddeler asittir.
Örneğin, HF nin suda çözünmesini incelersek,
HF + H2O
