Atom Yarıçapı
Atom çekirdeği ile son temel enerji düzeyindeki elektrnun arasındaki uzaklığa atom yarıçapı diyebiliriz. Elementlerde atom yarıçapları karşılaştırılırken aşağıdaki iki kural uygulanır.
1. Genellikle yörünge sayısı (temel enerji düzeyi) büyük olan element atomlarının çapı büyüktür.
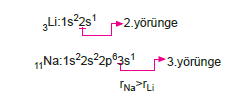
2. Elementler aynı yörünge sayısına sahip iseler, proton sayılarına bakılır. Proton sayısı büyük olanın, atom çapı küçüktür.
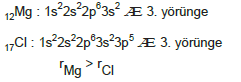
Proton sayısı büyük olan Cl atomunun elektronlarına uyguladığı çekim kuvveti daha fazladır. Bu nedenle elektronlar Mg atomuna göre çekirdeğe daha yakındır. Bu nedenle çap daha küçük olur.
İyon Yarıçapı
- Atom yarıçapı için kullanılan kurallar iyon yarıçapı için de geçerlidir.
- Pozitif bir iyonun( katyon) yarıçapı nötr atomunun yarıçapından daha küçüktür.
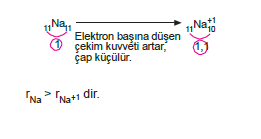
- Negatif bir iyonun (anyon) yarıçapı nötr atomunun yarı- çapından daha büyüktür.

Çekirdek Çapı
- Kimyasal olaylarda çekirdek yapısı (proton ve nötron sayısı) değişmeyeceğinden, çekirdek çapı da değişmez.
- Atom çapı yörünge ve elektronları da kapsadığından her zaman çekirdek çapından büyüktür. Elektron alıp vermeye bağlı olarak atomun çapı artar ya da azalır.


[kimya_ygs_lys]

soru az
açıklayıcı değil idare eder