Atom
Maddenin en basit hali elementtir. Elementler atomlar- dan oluşmuştur. Elementin özelliklerini taşıyan en küçük yapı taşına atom denir.
Atomun yapısının incelenmesi mılattan önceki yıllara da- yanır. Günümüze kadar oluşturulan atom teorileri bilim adamlarının katkıları sayesindedir.

Atom Teorileri
Dalton Atom Teorisi
Atom yunanca bir kelime olup anlamı “bölünemez” dir. Bu kavram Yunanlı filozof Democritos tarafından ortaya atılmıştır. Dalton, Democritos’un atom hakkındaki bu tanımı doğrulamıştır.
Dalton atom modelinde aşağıdaki ifadeler yer alır:
- Atom parçalanamaz.
- İçi dolu kürelerdir.
- Elementin tüm atomları özdeş olup, kütleleri aynıdır.
- Bileşikler farklı elementlerin sabit bir oranda birleş- mesinden oluşur.
- Farklı elementlerin özellikleri birbirinden farklıdır.
Dalton atom modelinin eksikleri ve hataları:
- Atom parçalanır. Bunun ispatı atom bombasının icadıdır.
- Elementlerin izotopları vardır. Yani aynı elementin farklı kütleli halleri doğada mevcuttur.
- Atomun daha çok boşluklu yapıya sahip olduğu bulunmuştur.
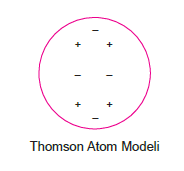
Thomson Atom Modeli
Thomson atom modelinde aşağıdaki ifadeler yer alır.
- Atomda negatif (–) yükü dengeleyen pozitif (+) yük bulunmalıdır. Yani atom nötr (yüksüz) olmalıdır.
- Negatif (–) ve pozitif (+) yükler atom içerisinde dağı- nık halde bulunmalıdır.
- (–) yüke elektron adını vermiştir.
Thomosonun bu modeline “üzümlü kek modeli” dendi.
Thomson atom modelinin eksikleri ve hataları:
- Elektronların dağınık ve (+) yükle iç içe olmadığı bulunmuştur.
- Bu modelde nötronlardan bahsedilmemiştir.
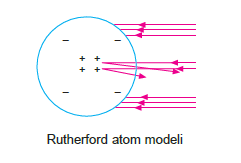
Rutherford Atom Modeli
Rutherford yaptığı deneyde He+2 (a) taneciklerini metal levha üzerine göndermiştir. Deney sonucunda He+2 (a) yüklü a+2 (alfa) taneciklerinin büyük çoğunluğunun levhadan geçtiğini, çok azının saptığını, birkaç tanesinin geri döndüğü gözlemlemiştir.
Rutherford atom modelinde aşağıdaki ifadeler yer alır.
- Atom kütlesinin çoğu ve (+) yük atomun merkezinde küçük bir hacimde toplanmıştır. Bu merkeze “çekir- dek” adı verilmiştir.
- Atomun büyük bir kısmı boşluktan oluşur.
- (–) yüklü elektronlar çekirdeğin etrafında bulunur.
- (+) yüke proton denir.
Rutherford atom modeli ile Thomson’un elektronlarla (+) yükün iç içe olduğu fikri çürütülmüştür.
Bu modelin eksik tarafı, elektronların nasıl yerleştiğini açıklayamamasıdır.
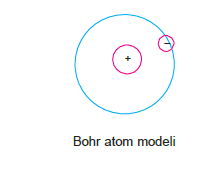
Bohr Atom Modeli
Bohr, atom modelini hidrojen atomu için açıklayabilmiştir.
Bohr Atom Modelinde aşağıdaki ifadeler yer alır:
- Elektron çekirdeğin çevresinde dairesel yörüngede hareket eder.
- Elektron belli dairesel yörüngelerde (enerji düzeyi) bulunabilir.
- Elektron, içinde hareket halinde olduğu yörüngenin enerjisini taşır. Çekirdekten uzaklaşan elektronun enerjisi artar.
- Elektron yörünge üzerinde ne kadar durursa dursun enerjisi değişmez.
- Elektronun çekirdeğe en yakın konumdaki hali temel haldir. Elektrona dışarıdan enerji verildiğinde daha yüksek enerjili düzeye (yörünge) çıkar. Bu duruma “uyarılmış hal” denir.
- Elektron yüksek enerji seviyesinden düşük enerji seviyesine geçerken enerji yayar.
Bohr atom modelinin eksik tarafı, bu modelin birden çok elektronu olan atomlara uygulanamayışı ve “elektronların belli dairesel yörüngede hareket eder.” ifadesidir.Bu modelden önce Chadwick tarafından yüksüz nötronlar bulunmuştur.
Modern Atom Teorisi
Modern atom teorisinde aşağıdaki ifadeler yer alır:
- l Elektronlar bir bulut halinde belli bir bölgeye dağılmıştır.
- Elektronlar hareketli tanecikler olduğu için aynı anda hem yeri hem de hızı bilinemez.
Bu modeldeki bazı kavramları açıklayalım.
Temel Enerji Düzeyi
Elektronların bulunduğu bölgelerdir. Enerji düzeylerinde maksimum bulunabilecek elektron sayısı 2n2 formülü ile hesaplanır.
n = Temel enerji düzeyi n2 = Orbital sayısı
n = 1 2.n2 = 2.12 = 2e
n = 2 2.n2 = 2.22= 8e
n = 3 2.n2 = 2.32 = 18e
(İlk üç enerji düzeyinde bulunabilecek elektron sayıları verilmiştir.)
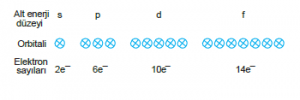
Alt Enerji Düzeyi
Her temel enerji düzeyi alt enerji düzeyi içerir. Alt enerji düzeyleri s, p, d ve f olmak üzere dört çeşitir. Alt enerji düzeyi Alabileceği elektron sayısı s 2 p 6 d 10 f 14
Enerji düzeylerinin sıralanışı aşağıdaki düzenden çıkarı labilir.

Orbital
Elektronların bulunma ihtimalinin en yüksek olduğu böl- gelerdir. Her orbital en fazla iki elektron alabilir. Alt ener- ji düzeyleri farklı sayıda orbital içerir.
ÖRNEK: Aşağıdakilerden hangisi Dalton atom modeli için yanlıştır?
A) Atom parçalanamaz.
B) Elementerin atomları her yönden özdeştir.
C) Farklı elementlerin atomları da farklıdır.
D) Elementler sabit oranda birleşerek bileşik oluşturur.
E) Atomdaki (+) ve (–) yükler iç içe dağılmıştır.
ÇÖZÜM: A, B, C ve D şıklarında yer alan özellikler Dalton’a aittir. E şıkkındaki, (+) ve (–) yüklerin iç içe dağıldığından Thomson bahsetmiştir.
Yanıt E
ÖRNEK: I. Atomdaki (+) yük çekirdekte toplanmıştır.
II. Elektronlar çekirdeğin etrafında yer alır.
III. Atomun büyük bir kısmı boşluktan oluşur.
Yukarıdakilerden hangisi Rutherford atom modelinde yer alır?
A) Yalnız I B) I ve II C) I ve III D) II ve III E) I, II ve III
ÇÖZÜM: Üç ifade de Rutherford atom modelinde yer alır.
Yanıt E
ÖRNEK: I. Orbitallerden bahsedilmiştir.
II. Elektronun yeri ve hızı bilinemez.
III. Yörüngelerin alabileceği en fazla elektron sayıları belirtilmiştir.
Çekirdek
Atom
Yörüngeler
Yukarıdaki bilgiler hangi atom modelinden alınmıştır?
A) Dalton B) Modern C) Thomson D) Rutherford E) Chadwick
ÇÖZÜM: Atom ilgili bu detaylar günümüzde kullanılan modern atom teorisinin sonucudur.
Yanıt B
ÖRNEK: Rutherford deneyinde ince altın levha üzerine gön- derilen a taneciklerinin küçük bir kısmının geri yan- sıması aşağıdakilerden hangisiyle açıklanır?
A) Atomda (+) ve (–) yükler dengelenmiştir.
B) Elektronlara çarpan a tanecikleri geri yansır.
C) Atomdaki (+) yük yoğun olarak küçük bir hacimde toplanmıştır.
D) Atomdaki (–) yüklü tanecikler a taneciklerini çeker. E) Atom hacminin büyük bir kısmı a tanecikleri için yansıtıcıdır.
1982 ÖSS
ÇÖZÜM: a tanecikleri (+) yüklüdür, (+) yüklü taneciklerin küçük bir kısmı geri dönüyorsa, (+) yüklü taneciklere çarpmış de- mektir. Demek ki (+) yük küçük bir hacimde toplamıştır.
Yanıt C
[kimya_ygs_lys]