a. Asitler
Suda çözündüğünde ortama H+ iyonu veren bileşiklere asit denir. Farkı bir tarifle asitler OH– iyonu ile reaksiyona girebilen bileşiklerdir. HCl, HBr, HI, HNO3, HClO3, H2SO4 başlıca kuvvetli asitlerdir. Kuvvetli asitler tam olarak iyonlaşarak suda çözünürler.
H3PO4, H2CO3, H2S, HF, HCN, CH3COOH başlıca zayıf asitlerdir. Bu bileşikler ise suda biraz moleküller halinde, biraz da iyonlaşarak çözünürler. Bu yüzden suya H+ iyonu verme yeteneği, zayıf asitlerde daha azdır.
Asitlerin değerliği suya verebildiği H+ iyonu sayısı ile bulu- nur. HCl, HBr, HNO3 1 değerli, H2SO4, H2CrO4, H2CO3 2 değerli ve H3PO4 3 değerli asitlerdir.
Asitlerin genel özellikleri şunlardır,
1. Suda iyonlaşarak çözünürler.
2. Çözeltileri elektriği iletir.
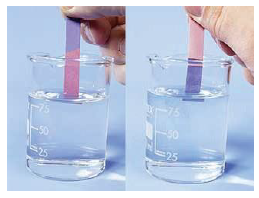
3. Turnusol kağıdını kırmızıya boyarlar.
4. Tadları ekşidir.
5. Soy metaller dışında bütün metallerle reaksiyona girerek tuz ve hidrojen gazı oluştururlar.
Mg + 2HCl Æ MgCl2 + H2(g)
Metal Asit Tuz Hidrojen gazı
Cu + HCl Æ Tepkime vermez.
Cu + 2HNO3 Æ CuNO3 + NO2 + H2O
Yarı Soy Asit Tuz Su
Metal
NOT: Yarı soy metaller asitlerle tepkimeye girdiğinde asitte- ki kökün gazı açığa çıkar,
6. Bazlarla nötürleşerek tuz ve su oluştururlar
HCl + NaOH Æ NaCl + H2O
Asit Baz Tuz Su
b. Bazlar
Suda çözündüğünde ortama OH iyonu veren bileşiklere baz denir. Farklı bir tarifle, bazlar H+ iyonu ile reaksiyona girebilen bileşiklerdir. 1A grubu metali hidroksitleri LiOH, NaOH, KOH … kuv- vetli bazdır. Bu bileşikler suda iyi çözünürler. Diğer bütün metallerin hidroksit bileşikleri ise suda az çözündüğü için zayıf bazdır. Metal hidroksitleri dışında akla ilk gelen diğer bir baz NH3 dür. Amonyak kovalent bağlı bileşik olduğu için suda daha çok moleküler halinde çözünür. Fakat az da olsa çözeltide NH+ ve OH– bazdır. iyonları bulunur. NH3 zayıf bir Bazların değerliği suya verebildiği OH iyonu sayısı ile bulunur. NaOH, KOH 1 değerli, Mg(OH)2, Fe(OH)2 2 değerli, Al(OH)3, Cr(OH)3 3 değerli bazlardır.
Bazların genel özellikleri şunlardır
1. Suda iyi çözünürler.
2. Çözeltileri elektriği iletir.
3. Turnusol kağıdını maviye boyarlar.
4. Tatları acıdır.
5. Çözeltileri ele kayganlık hissi verir.
6. Anfoter metaller dışında metallerle reaksiyona girmez- ler. (Anfoter metaller: Zn, Al, Cr, Sn ve Pb dir).
Anfoter metal: Hem asitle hem de bazla tepkimeye gi- rer H2 gazı açığa çıkarır.
Al + 3HCl Æ AlCl3 + fH2(g)
Al + 3NaOH Æ Na3AlO3 + fH2(g)
7. Asitlerle nötürleşerek tuz ve su oluşturur.
ÖRNEK: Her çözeltinin sadece bir maddeyi çözme şartıyla CO2, Ca, Ag ve Pt den oluşan karışımdaki Pt yi ayrıştırmak için,
I. HCl çözeltisi
II. NaOH çözeltisi
III. H2SO4 çözeltisi
çözeltileri hangi sıra ile karışıma eklemek gerekir?
A) I, II, III B) II, I, III C) III, I, II D) I, III, II E) II, III, I
ÇÖZÜM: CO2, Ca, Ag, Pt karışımına önce NaOH çözeltisi eklenir- se, CO2 ortamdan ayrılır. Geriye kalan karışıma HCl ila- ve edilirse Ca da karışımdan ayrılır. Kalan Ag–Pt karışı- mına ise H2SO4 ilave edilirse Ag karışımdan ayrılır ve geriye Pt kalır. Buna göre çözeltiler karışıma II, I, III sıra- sıyla ilave edilmelidir.
Yanıt B
c. Tuzlar
Asit ve bazların nötrleşme ürünüdür.
İyonik bağlı bileşiklerdir.
Tuzlar kendi aralarında sınıflandırılır,
1. Asidik Tuzlar
2. Bazik Tuzlar
3. Nötr Tuzlar
4. Çift Tuzlar
5. Kompleks Tuzlar

1. Asidik Tuzlar
Kuvvetli bir asitle, zayıf bir bazın reaksiyonundan oluş- muş tuzlar asidik tuzlardır.
Örneğin,
CaCl2, FeBr3, AgNO3, NH4Cl … gibi.
2. Bazik Tuzlar
Kuvvetli bir bazla zayıf asidin reaksiyonundan oluşmuş tuzlar bazik tuzlardır.
Örneğin,
NaCN, K2S, CH3COONa, Li2CO3 … gibi.
3. Nötr Tuzlar
Kuvvetli bir asitle, kuvvetli bir bazın nötrleşmesi sonucu oluşan tuzlara nötr tuz denir.
Örneğin,
KNO3, NaCl, LiBr … gibi.
4. Çift Tuzlar
Aynı asit köküne sahip iki tuzun meydana getirdiği ortak iyonik kristallerdir.
Örneğin,
KAl(SO4)2.12H2O … gibi
5. Kompleks Tuzlar
Asit kökleri ile aynı iki tuzun yaptığı bileşiklerdir. Anyon, katyonlardan biriyle kompleksleşmiş durumdadır.
Örneğin,
Fe3[Fe(CN)6]2, K2HgI4 … gibi
d. Oksitler
OF2 dışında oksijenin, iki cins atom bulunduran ve –2 değerlik aldığı bütün bileşiklerine oksit denir.
Oksit bileşikleri kendi aralarında sınıflandırılır.
1. Nötr oksitler
2. Anfoter oksitler
3. Asit oksitler
4. Bazik oksitler
5. Peroksitler
6. Bileşik oksitler
1. Nötr Oksitler
Ametallerin oluşturduğu bir oksijenli oksitlerdir. Suda çözündüğünde asit ya da baz oluşturmazlar.
NO, N2O, CO gibi…
2. Anfoter Oksit
Anfoter metallerin oksitleridir. Anfoter oksitler hem kuv- vetli asitlerle hem de kuvvetli bazlarla tepkime verirler. Suda çözünmezler.
Al2O3, ZnO, Cr2O3… gibi
3. Asit Oksitler
Ametallerin oksitleridir. CO2, SO2, N2O5 … gibi.
– Suda çözündüklerinde asit oluştururlar.
SO3 + H2O Æ H2SO4
– Bazlarla nötrleşme tepkimesi verirler.
SO3 + Ba(OH)2 Æ BaSO4 + H2O
4. Bazik Oksitler

Metallerin oksitleridir. K2O, Na2O, CaO … gibi
– Suda çözündüklerinde baz oluştururlar.
BaO + H2O Æ Ba(OH)2
– Asitlerle nötrleşme tepkimesi verirler.
BaO + 2HCl Æ BaCl2 + H2O
5. Peroksitler
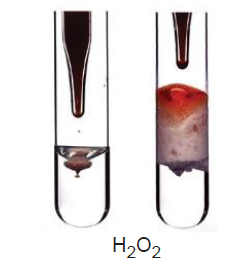
Oksijenin –1 değerlik aldığı bileşiklere peroksit denir.
K+1 –2 2O Æ Potasyum oksit
K+1 –1 2O 2 Æ Potasyum peroksit
Sadece 1A ve 2A gruplarının peroksitleri vardır
Örneğin,
H2O2, Na2O2, MgO2, CaO2 … gibi
ÖRNEK: Aşağıdaki bileşiklerden hangisinde oksijenin değer- liği diğer dördünden farklıdır? (H,Na: 1A; Mg,Ca: 2A; C: 4A; O: 6A grubu elementleridir.)
A) Na2O2 B) H2O2 C) MgO2 D) CaO2 E) CO2
2001 ÖSS
ÇÖZÜM:

6. Bileşik Oksitler

Yapısında aynı elementin değişik değerlikli iyonlarını birarada bulunduran bileşiklerdir.
[kimya_ygs_lys]
