Çözeltiler

Homojen karışımlara çözelti denir.
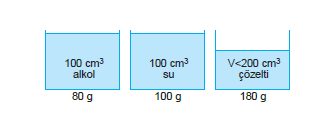
80 g 100 g 180 g
Fiziksel yöntemlerle oluşurlar ve farklı fiziksel hallerde olabilirler. Görünüşüne göre çözeltiler, katı (alaşımlar), sıvı (tuzlu su) veya gaz (hava) olabilirler.
Sıvı Çözeltiler
Çözücüsü sıvı olan çözeltilerdir. Çözünen maddeye göre çeşitleri vardır.
Çözücü Çözünen Çözelti
S›v› Kat› Tuzlu su
S›v› S›v› Alkollü su
S›v› Gaz Oksijenli su
Çözelti kütlesi, çözücü ve çözünen kütleleri toplamına eşittir.
mçözelti = mçözücü + mçözünen
Çözelti hacmi ise farklı yorumlanır,
- Çözünen katı ise çözelti hacmi, çözücü hacmine eşittir.

- Çözünen sıvı ise çözelti hacmi, çözücü ile çözünen maddelerin hacimleri toplamından azdır.
Vçözelti < Vçözücü + Vçözünen
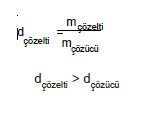
- Çözelti özkütlesi
a. Çözüneni katı olan çözeltilerde,
b. Çözüneni sıvı olan çözeltilerde,
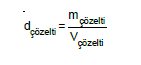
Çözünme Olayı
Çözeltilerde meydana gelen fiziksel çözünme, çözünen maddenin tanecik ya da iyonlarının çözücü molekülleri arasındaki boşluklara yerleşmesidir.
Bu olayda iç yapı değişmeyip tanecik ya da iyonlar sa- dece birbirinden uzaklaşır.
Fiziksel çözünme iki tiptir,
1. Dağılma
Çözünme molekülerdir. Çözelti iyon içermediğinden ilet- ken değildir.
Örneğin,
Şekerli su, alkol – su, …
2. İyonlaşma
Çözünme iyoniktir. Çözelti iyon içerdiğinden iletkendir.
İyonik çözeltilerin elektriği iletmesi kimyasaldır.
Örneğin,
Tuzlu su, asit ve baz çözeltileri ….
Çözeltilerin Karıştırılması
- Aynı maddelerin çözeltileri veya her hangi bir iyonu ortak bulunduran çözeltiler karıştırıldığında tepkime olmaksızın gelen iyonlar ortamda bulunur. Karışma sonrası çözünen oranı artabilir, azalabilir ya da değişmeyebilir.
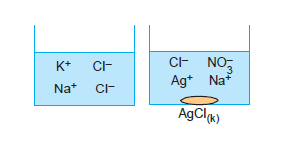
- Farklı maddelerin çözeltileri karıştırıldığında tepkime gerçekleşebilir. Bu durumda tepkimeye giren iyonlar ortamdan ayrılarak çöker ya da oluşan ürün tekrar iyonlaşabilir.

a. Nötrleşme: H+ ve OH– iyonları karıştırıldığında birleşip H2O (sıvı) oluşturarak iyon ortamından ayrılır.
b. Çökme: Karışan çözeltilerin iyonları arasında, çözünmeyen tuzlar oluşarak çökme meydana getirebilir.
[kimya_ygs_lys]
