Çözünürlük Dengesi
Belirli bir sıcaklıkta doymuş 1 litre çözeltideki çözünmüş maddenin mol miktarına, maddenin çözünürlüğü denir. 25°C ve 1L doymuş çözeltideki çözünmüş maddenin mol cinsinden değerine maddenin standart molar çözünürlüğü denir.
Standart çözünürlüğü 0,1M ve daha büyük olan madde- lere suda çok çözünebilen madde denir. Çözünürlüğü 0,1M dan daha az olan maddeler suda az çözünen mad- deler olarak bilinir
1. Alkali metal içiren bileşikler
(Li+ Na+ K+ Rb+ Cs+)
Örneğin,
KNO3, CH3COONa, Na2CO3, KOH bileşiklerinin çözü- nürlükleri 0,1M veya 0,1M dan daha büyüktür.
2. NO– ve NH+ iyonu içeren bileşikler suda çok çözü-nen maddelerdir.
3. Suda çözündüğünde H+ iyonu oluşturan bileşikler, suda çok çözünen maddelerdir.
4. Pb+2, Ag+1, Hg+2, Cu+1, F–, Cl–, Br– ve I– iyonlarının yaptığı bileşikler suda az çözünen maddelerdir.
5. 2A grubu elementlerinin SO–2 ve CO–2 iyonları arasında oluşturduğu bileşikler az çözünen maddelerdir.
Çözünürlük Dengesi

Özkütlesi sudan büyük olan bir katı madde suda çözülerek doymuş çözelti oluşturursa bu doymuş çözeltiye sabit sıcaklıkta, daha fazla aynı katı maddeden eklendiğinde eklenen katı madde kabın dibine çöker. Böyle bir sistemde sıcaklık değişmedikçe kabın dibindeki katı madde miktarı değişmez.
Ancak katı fazdaki moleküllerle, sudaki molekül veya iyonlar arasında bir dinamik denge olur. Bu dengeye çözünürlük dengesi denir.
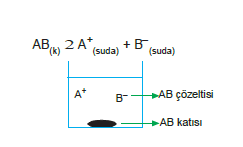
Kç (Çözünürlük Çarpımı)
Az çözünen iyonlu katıların, doygun çözeltisi içerisinde bulunan iyonların derişim çarpımına, çözünürlük çarpımı denir.
- Denge sabiti çok az çözünen iyonlu katılar için uygulanır.
- Her iyonlu katının standart bir Kç değeri vardır. (25°C deki Kç)
- Sıcaklık arttıkça Kç artıyorsa sistem endotermik, sı- caklık arttıkça Kç azılıyorsa sistem ekzotermiktir.
Aşağıda bazı tepkimelerin Kç bağıntıları verilmiştir.
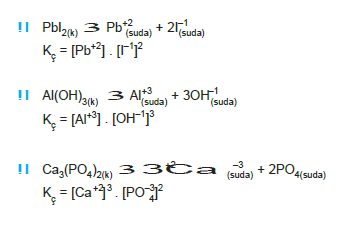


Ortak İyonun Çözünürlüğe Etkisi
Herhangi bir tuzun ortak iyon bulunan bir çözelti içerisin- deki çözünürlüğü, saf sudaki çözünürlüğünden azdır
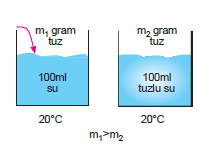
NOT: Çözelti içerisinde ortak iyon derişimi arttıkça, çözünürlük giderek azalır.
[kimya_ygs_lys]
