Elektronegatiflik
Bir atomun bağ elektronlarını çekme gücünün ölçüsüdür. Elektronegatifliği yüksek olan atom bağ elektronlarını da- ha kuvvetli çeker. Kovalent bağ apolar ve polar olmak üzere 2 tür olabilir.
a. Apolar kovalent bağ
Aynı ametal atomları arasında kovalent bağ oluşuyorsa, atomların elektronegatiflikleri aynı olduğundan atomlar arasında yük dağılımı dengeli olur. Bağ elektronları her iki atom tarafından eşit kuvvetle çekilir. Kutuplaşma olmaz. Bu şekildeki bağa apolar kovalent bağ denir. H2, O2, N2, F2 moleküllerinde apolar kovalent bağ görülür.
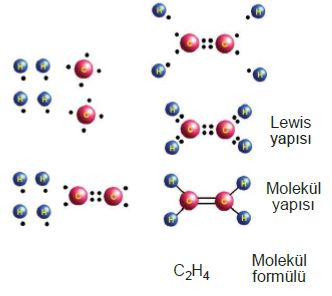
b. Polar kovalent bağ
Elektronegatiflikleri farklı olan atomlar arasında, bağ elektronları eşit kuvvetle çekilmez. Elektronegatifliği yüksek olan atom, bağ elektronlarını daha güçlü çeker. Bu tür bağlara polar kovalent bağ denir.
HCI, HF, NH3, H2O moleküllerinde polar kovalent bağ görülür.
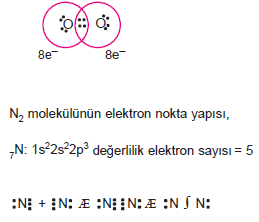
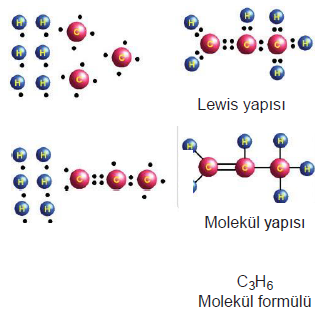
Elektron Nokta Yapısı (Lewis Formülü)
Elektron nokta yapısında, atomun değerlik elektronları, elementin simgesi çevresinde birer nokta ile gösterilir.


O2 molekülünde O atomları ikişer elektronlarını ortaklaşa kullanarak (2 çift elektronu) değerlilik elektronlarını 8’e tamamlar.
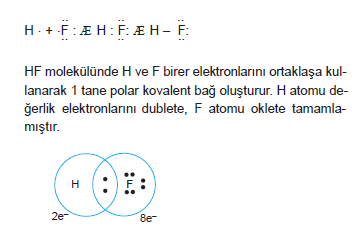
HF molekülünün elektron nokta yapısı,
[kimya_ygs_lys]
