Hidrojen atomunun enerji seviyeleri ve spektrumu
- Uyarılmış hidrojen atomlarında elektron yüksek enerji seviyesindeki yörüngeden, düşük enerji seviyesindeki yörüngeye geçişinde yaptıkları ışımalara sprektrum serileri denir.
- İyonlaşma hali altındaki enerjileri atomların toplam enerjilerine eşittir.
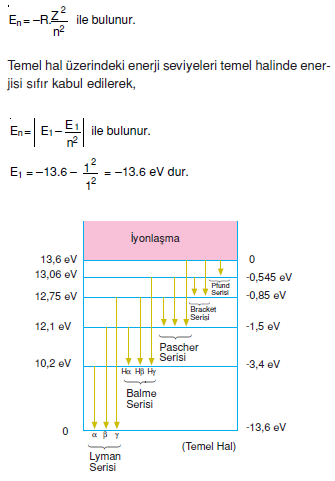

Lyman Serisi (Mor ötesi ışınlar)
- Üst enerji seviyelerinden n = 1 enerji seviyesine geçişle atomun yayınladığı fotonlardan oluşur.
Balmer Serisi (Görünür Işınlar)
- Üst ünerji seviyelerden n = 2 enerji seviyesine geçişte oluşur.
Paschen Serisi (Kızıl ötesi ışınlar)
- Üst enerji seviyelerinden n = 3 enerji seviyesine geçişte oluşur.
Bracket serisi
- Üst enerji seviyelerinden n = 4 enerji seviyesine geçişlerde oluşur.
Pfund Serisi
- Üst enerji seviyelerinden n = 5 enerji seviyesine geçişlerde oluşur.

Bohr Atom Modelinini Yetersizlikleri
1. Bohr atom modeli sadece tek elektronlu atomların yapısını açıklamaktadır. Çok elektronlu atomların yapısını açıklamakta yetersizdir.
2. Bohr atom modeli spektrum çizgilerinin ince yapı yarılmalarını, sebebini açıklayamaz.
[fizik_2_ygs_lys]
