İdeal Gaz Denklemi
Gazlar yüksek sıcaklık ve düşük basınçta idealliğe yaklaşırlar.
P.V = n.RT
P: Basınç (atm)
V: Hacim (L)
n: mol
T: Sıcaklık (K)
R: İdeal gaz sabiti
- Gazların yoğunluğu ideal gaz denklemine bağlı olarak,
P.MA = d.RT
eşitliği ile bulunur.
MA: Gazın mol kütlesi
d: Gazın yoğunluğu (g/L)
Gazların su üstünde toplanması
Suda çözünmeyen bazı gazlar su üzerinde toplanabilir- ler. Buradaki gaz basıncı hesaplanırken suyun buhar basıncı da ihmal edilmemelidir.
Atmosfer basıncı, hacim değişikliği sıvı miktarı gibi nice- liklerin değişmesi denge buhar basıncının değerini değiştirmez.
Sıcaklık artarsa sıvının denge buhar basıncı artar.
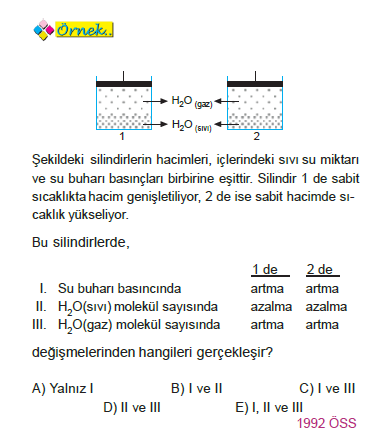
ÇÖZÜM: I. Kap:Hacim artışı denge buhar basıncını etkilemez. Ancak daha geniş hacimde aynı basıncı yapması için sıvı molekülleri gaz faza geçer. Sıvı molekül sayısı azalır gaz molekül sayısı artar.
II. Kap:Sıcaklık artışı ise denge buhar basıncını artırır. Sıvı molekül sayısı azalırken, gaz molekül sayısı artar.
Yanıt D
UYARI: Kimyasal tepkimeye giren gazlar karıştırıldığında kimyasal hesaplama yapılarak ortamdaki toplam gaz molekülleri için gerekli gaz yasası uygulanır.
ÖRNEK: Gaz halindeki belli bir miktar maddeye,
I. Sabit hacimde sıcaklığının artırılması,
II. Sabit sıcaklıkta basıncının artırılması,
III. Tamamının sıvılaştırılması
işlemlerinin hangileri uygulandığında, o maddenin moleküller arası uzaklığının azalması beklenir?
A) Yalnız I B) Yalnız II C) Yalnız III D) I ve II E) II ve III
2003 ÖSS
ÇÖZÜM: Moleküller arası uzaklığın azalması hacmin küçülmesi demektir.
I. öncülde hacim sabittir. (olmaz.)
Sabit sıcaklıkta basıncın artması için hacim azalmalıdır. (II olur)
Sıvılaşan gazların hacmi azalır. (III olur.)
Yanıt E
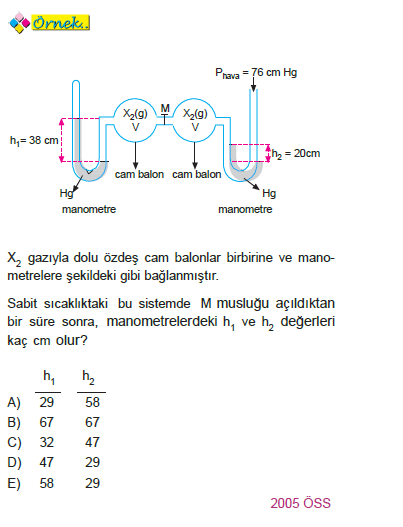
ÇÖZÜM: Mol sayıları yerine gazların P.V çarpımlarını kullanalım. n1 = 38.V n2 = (76–20). V
nT = PT.VT
38V + 56V = PT.2V
PT = 47 cm Hg
Kapalı uçlu monametrelerde 47 cm açık uçluda ise sol kolda 76 – 47 = 29 cmHg seviyesi farkı olur.
Yanıt D
[kimya_ygs_lys]
