Tepkime Hızı

Kimyasal olaylardaki değişme, madde miktarındaki değişmedir.
Buna göre, tepkime hızı “birim zamanda madde mikta- rındaki değişimdir.” Değişime girenler için azalma, ürün- ler için artma şeklinde meydana gelir.

N2(g) + 3H2(g) Æ 2NH3 (g)
1 mol 3 mol 2 mol
Belli bir Δt süresi Belli bir Δt süresi içinde harcanır içinde oluşur.
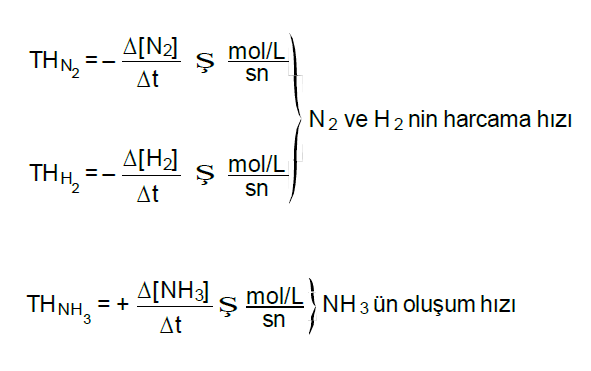
Tepkime hızlarının karşılaştırılması,
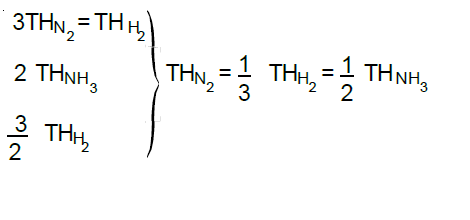
Tepkime Hızının İzlenmesi
Tepkime sırasında ölçülebilen bir fiziksel değişme gözlemlenebilir.
1. Basınç-Hacim
2. Renk
3. İletkenlik
gibi fiziksel özelliklerin değişimi tepkimenin gidişatı hakkında bilgi verir.
ÖRNEK: Hem basınç hem de hacim artış veya azalmasıyla tepki- me hızı izlenebilir.
Mg + 2HCl(suda) Æ MgCl2(suda) + H2(g) (Gaz çıkışı)
N2(g) + 3H2(g) Æ 2NH3(g) (Basınç azalması)
C2H4(g) + Br2(suda) Æ C2H4Br2(g) (Renk takibi)
Renksiz kırmızı renksiz
Renk değişimiyle tepkime hızı izlenir.
H2(g) + Cl2(g) Æ 2HCl(g) (Renk takibi) renksiz yeşil renksiz
İyon değişimi sonucunda iletkenlik de değiştiğinden tep- kime hızı izlenir.
Çarpışma Teorisi
Bir kimyasal tepkimenin gerçekleşmesi için tepkimeye giren taneciklerin çarpışmaları gerekir. (Her çarpışma tepkime vermeyebilir.) Bu taneciklerin çarpışırken belli bir doğrultuya, belirli bir enerjiye sahip olmaları gerekmektedir. Bu tür çarpışmalara etkin çarpışma denir.
Aktifleşme (Eşik) Enerjisi:
Bir kimyasal tepkimeden tepkimeye giren taneciklerin ürü- ne dönüşebilmeleri için gerekli olan minimum enerjidir. Aktifleşme enerjisi ne kadar küçük ise tepkime o kadar hızlıdır.
Çarpışan tanecikler etkin çarpışma yaparsa yüksek enerjili kararsız ara ürünler oluşur. Bu ürüne aktifleşmiş komplex denir.
NOT: İleri aktifleşme enerjisi (Ea )ile geri aktifleşme enerjisi i
(Ea ) farkı bize ΔH ı (tepkime ısısı) verir.
[kimya_ygs_lys]
