Modern Atom Modeli (Elektron Kabukları)
- Modern atom teorisinde elektronlar çekirdek çevresinde elektron bulutları halindedirler. Elektronların bulunma ihtimalinin yüksek olduğu bu bölgelere orbital adı verilir.
- Elektronun atomdaki yeri ve durumunu belirlemek için dört tane kuantum sayısı kullanılır.
1. Bas Kuantum Sayısı
- Bu sayı elektronun çekirdekten uzaklığını belirler. n ile gösteriliyor olup, n = 1, 2, 3 … değerlerini alır. n küçüldükçe elektronun atoma uzaklığı küçük bağlanma enerjisi büyüktür.
- K kabuğu n = 1
- L kabuğu n = 2
- M kabuğu n = 3
- N kabuğu n = 4
- P kabuğu n = 5
2. Orbital Kuantum Sayısı (I)
- Alt kabuk sayısını belirler. Atomlarda elektron bulutlarının oluşturduğu elektrik alanlarının birbiriyle ya da dış elektrik alanla etkileşmesi sonucu enerji seviyelerindeki ayrılmaların nasıl olacağnıı gösteren ya da elektronun açısal momentumunu belirleyen kuantum sayılarıdır.
- I = 0, 1, 2, 3, ……… (n–1) değerlerini alabilir.

3. Magnetik kuantum sayısı (mI)
- Alt kabuktaki orbital sayısını verir. Elektronların çekirdek çevresinde dolanırken oluşturduğu akım magnetik alanlar meydana getirir. Bu magnetik alanla etkileşerek enerji seviyelerinde tekrar ayrılmalar meydana getirir ve alt kabuklar içinde yeni alt kabuklar oluşur. Bunlar orbitallerdir.


4. Dönme (Spin) magnetik kuantum sayısı (ms )
- Elektronlar hem çekirdek çevresinde hem de kendi eksenleri etrafında dönme hareketi yapar. Kendi eksenleri etrafında dönerken bir magnetik alan oluşur. Dönme iki farklı yönde olabileceği için magnetik alanla etkileşime girerken enerji seviyelerinde tekrar ayrılmalara neden olur. Sperktrum çizgilerinin ince yapıda oluşunun nedeni bu ayrılmalardır.
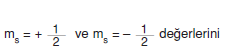
- alabilir. Yalnızca iki değer alabilmesi bir orbitalde iki elektron bulunabileceğini gösterir. ms nin (+) değer alması dönmeden oluşan magnetik alanın dış magnetik alanla aynı yönlü olmasını, (–) değer alması zıt yonlü olmasını açıklar.
Pauli Prensibi
- Bir atomda tüm kuantum sayıları biribirinin aynı olamaz. n, I. mI, ms değerlerinden en az biri farklı olacaktır.
[fizik_2_ygs_lys]
