Öz Hacim
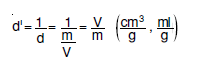
gibi birimler kullanılabilir.
Özısı (Isınma Isısı, c)
Maddenin 1 gramının sıcaklığını 1°C yükseltebilmek için gerekli olan ısı miktarına özısı denir.
Örneğin, Suyun özısısı (csu) = 1 kal/g°C dir.
Çözünürlük
Sabit sıcaklıkta 100 cm3 çözücü içerisinde en çok çözünebilen madde miktarına maddenin çözünürlüğü denir.Birimi genellikle (g/100 cm3 su) şeklindedir.
Çözünürlüğe Etki Eden Faktörler
- Çözünenin türü
- Çözücünün türü
- Sıcaklık
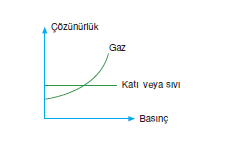
- Basınç (sadece gazların çözünürlüğüne etki eder.)
- Ortak iyon
- Katıların sudaki çözünürlükleri sıcaklık yükseldikçe genellikle artar. Gazların çözünürlüğü ise azalır.
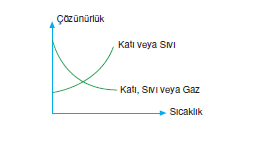
- Gazların çözünürlükleri basınç arttıkça artar.
Genleşme
Isı karşısında maddenin hacminde meydana gelen değişmedir. Genleşme katı ve sıvılar için ayırtediciyken, gazlar için ayırtedici değildir. Çünkü bütün gazlar, ısı karşısında aynı oranda genleşirler. Yani gazların genleşme katsayıları aynıdır.
Esneklik
Bir maddenin, bir kuvvetin etkisiyle şeklinde meydana gelen geçici değişmedir. Sadece katılarda ayırtedicidir.
Kaynama Noktası
Maddenin buhar basıncının dış basınca eşit olduğu andaki sıcaklığına denir.
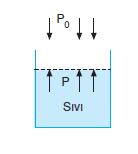
- Madde miktarına bağlı değildir.
Örneğin,
Aynı koşullarda 10 g su ile 100 g su aynı sıcaklıkta kaynar.
- Maddenin türüne bağlıdır.
Örneğin,
Normal şartlarda (0 °C, 1atm basınçta) alkol 78 °C de, su ise 100 °C de kaynar.
- Dış basınca bağlıdır. Dış basınç arttıkça maddenin kaynama noktası yükselir. Deniz seviyesinden yüksek yerlere çıkıldıkca dış basınç azalacağından
maddenin kaynama noktası düşer. - Maddenin saşık derecesine bağlıdır. Saf bir sıvıda, uçucu olmayan bir madde çözündüğünde kaynama noktası yükselir. İyon sayısı arttıkça K.N artar.
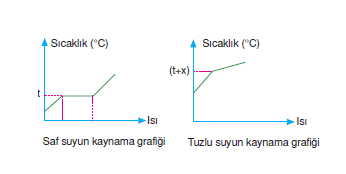
Tuzlu suyun kaynama noktası saf suyunkinden yüksektir.
Kaynama süresi
- Isıtıcı gücüne bağlıdır, ısıtıcı gücü arttıkça kaynama süresi kısalır.
- Sıvı miktarına bağlıdır, sıvı miktarı arttıkça kaynama süresi uzar.
- Karıştırmaya bağlıdır, sıvı karıştırıldıkça kaynama süresi kısalır.
- Kaynama noktası, aynı ortamdaki sıvılar için ayırt edici, kaynama noktasının tersi olan yoğunlaşma noktası ise gazlar için ayırtedici özelliktir.
Örnek:
l. Sıvıyı önce soğutup sonra ısıtmak
ll. Sıvıda uçucu olmayan katı çözmek
lll. Sıvının miktarını artırmak
lV. Sıvıyı bulunduğu yerden alçaklara götürmek.
Yukarıdaki hangi işlemler sonucu sıvının kaynama noktası değişir?
A) II ve III B) ll velV C)lll ve lV D) l, II ve III E) ll, lll ve lV
Çözüm: Sıvının kaynama noktasını, sıvının cinsi, saşığı, sıvıya uygulanan dış basınç değiştirir. Önce soğutup sonra ısıtmak ve madde miktarını artırmak sıvının kaynama noktasını değiştirmeyecektir.
Yanıt B
[kimya_ygs_lys]

Güzelmiş ya