Periyodik Cetvel Özellikleri
Atom çapı iki kurala göre değişir.
1. Periyodik cetvelde periyot numarası arttıkça (yukarı-dan aşağıya doğru) atomların çapı da artar.

2. Periyodik cetvelde aynı periyotta soldan sağa doğru gidildikçe (metallerden soygazlara doğru) atomların çapı azalır

Aynı yörünge sayısına sahip atomlardan çekim kuvveti (proton sayısı) büyük olanın çapı daha küçüktür. Çünkü elektronlarını kendisine daha fazla yaklaştırır.
NOT: Atom çapı, atom yarıçapı ve atom hacmi ile ilişkili kavramdır

İyonlaşma Enerjisi
Gaz halindeki nötr bir atomdan elektron koparmak için gerekli olan enerjiye iyonlaşma enerjisi denir.

Elementlerin iyonlaşma enerjilerinin karşılaştırılmasında aşağıdaki kural uygulanır.
1. İlk olarak değerlik elektronları sayısına bakılır. Değerlik elektronları sayısı büyük olanın, iyonlaşma enerjisi genellikle büyüktür.
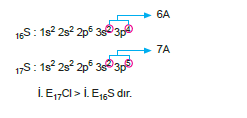
2. Değerlik elektron sayıları aynı ise (aynı A grubu ele- mentleri) periyot numaralarına bakılır. Periyot numa- rası küçük olanın, iyonlaşma enerjisi büyüktür.
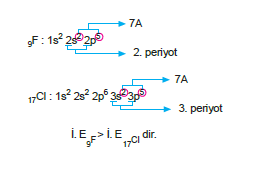
3. Tanecikler, izoelektronik iseler, proton sayılarına ba- kılır. Proton sayısı büyük olanın iyonlaşma enerjisi büyüktür.
Jl Periyodik sistemde soldan sağa ve aşağıdan yuka- rıya doğru iyonlaşma enerjisi artar. Atom çapı ile ters orantılıdır.
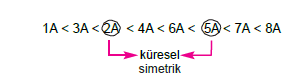
Jl Bir periyot elementlerin 1. iyonlaşma enerjilerindeki sıralanış şöyledir.
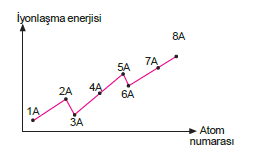
Jl 3. periyot elementlerinin atom numaralarının iyonlaş- ma enerjisi değişimini veren grafik aşağıdaki gibidir.

Tablolu İyonlaşma Enerjisi
Jl Ardışık iyonlaşma enerjileri arasındaki ~2,5 – 3 kat yada fazlası bir artış serbest elektron sayısını belir
ler.
Aşırı artış E1 den E2 ye geçişte olursa değerlik elekt-ron sayısı 1 yani 1A grubu elementidir. Aşırı artış E2
den E3 e geçişte olursa değerlik elektron sayısı 2 ya-ni 2A grubunda demektir.


Elektron İlgisi
Gaz halindeki nötr bir atoma 1 elektron eklenmesi sıra- sında açığa çıkan enerjiye elektron ilgisi denir.
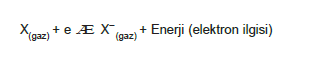
- Açığa çıkan enerji ne kadar büyük olursa elektron il- gisi de o kadar büyük olur.
- Elementlerin elektron ilgileri genellikle,
– değerlik elektron sayısıyla doğru orantılı
– çapla ters orantılı olarak değişmektedir.

[kimya_ygs_lys]
