Periyodik cetvel ve özellikleri
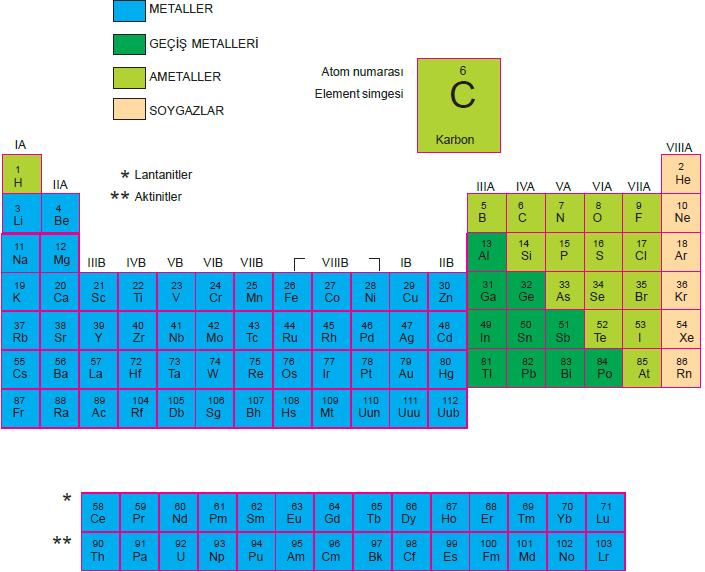
Periyodik cetvel fiziksel ve kimyasal olarak biribirine ben- zeyen elementleri gruplandırmak için oluşturulmuştur. Bu cetvel, elementlerin artan proton sayılarına göre düzenlenmiştir.
Periyot
Periyodik cetvelde yatay sıralara periyot denir.Jl Aynı periyotta bulunan elementler için
Periyot numarası = Temel enerji düzeyi sayısı
= En yüksek başkuant sayısı
= Yörünge (kabuk) sayısı
eşitlikleri yazılabilir.
Periyodik cetvel 7 periyottan oluşmaktadır.
Grup
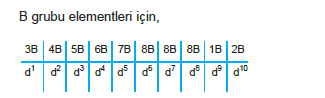
Periyodik cetvelde düşey sütunlara (kolonlara) grup de- nir. 8 sütündan oluşan 8 tane A grubu ve 2A ile 3A ara- sında 10 sütundan oluşan 8 tane B grubu vardır.
UYARI
- Aynı grupta bulunan elementler benzer kimyasal ve fiziksel özellik gösterirler.
- A grubu elementlerine baş grup, B grubu elementle- rine de geçiş elementleri denir.
- B grubu elementleri 4. periyottan itibaren başlar. Ay- rıca 6. ve 7. periyotların kapsamında olan Lantanit- ler ve Aktinitler periyotları vardır. Bu periyotlardaki elementlerin tümü grubundadır ve periyodik cet- velin altında gösterilir.
- Grup numarası = Değerlik elektron sayısı (Bazı B grupları ve 2He hariç)
[ad1]
Blok Türleri
Elementler elektron dağılımlarına göre dört blok altında toplanırlar.
Elementlerin, temel hal elektron dizilişlerinde en yüksek enerjili (en son) elektronların bulunduğu orbital türü blok türünü belirler.

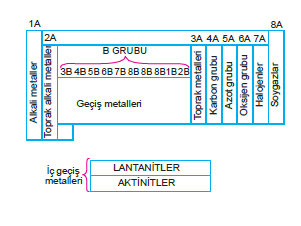
Bazı grupların özel isimleri,
1A: Alkali metaller grubu
2A: Toprak alkali metaller grubu
3A: Toprak metaller grubu
7A: Halojenler grubu
8A: Soygazlar grubu
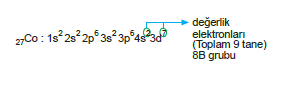
B Grubu: Geçiş elementleri (d ve f bloğu elementleri)
1A Grubu (Alkali metaller)
- Grubun ilk üyesi H hariç (Ametal) hepsi metaldir.
- Değerlik elektron sayısı 1 dir.
- En aktif metal grubudur.
- Isı ve elektriği iyi iletir.
- Tel ve levha haline getirilebilir.
- Doğada bileşikleri halinde bulunur. (NaCl gibi)
- Bileşiklerinde +1 değerlik alır.
- Elektron dağılımı s1 ile biter.
- Kendi aralarında alaşım denilen çözeltileri oluşturur.
- Ametallerle iyonik bağlı bileşik oluşturur.
- Gruplarda yukarıdan aşağıya inildikçe metalik aktif- lik artar.
- Oda koşullarında Hg hariç katı haldedir.
ÖRNEK: s bloğu elementleri için,
I. Tümü metaldir.
II. Son orbitalleri s ile biter. III. Baş grup elementidirler.
yargılarından hangileri doğrudur?
A) Yalnız I B) Yalnız II C) I ve II D) II ve III E) I, II ve III
ÇÖZÜM: 1H : 1s
– s bloğu (ametal)
s bloğu elementlerinin tümü metal değildir. (I. Yanlış)
Blok türünü, son orbital belirlediğinden tümü s ile biter. (II. Doğru)
s bloğu elementlerinin tümü A grubu (baş grup) elemen- tidirler. (III. Doğru)
YANIT: D
2A Grubu (Toprak Alkali Metaller)
- Elektron dağılımları s2 ile biter.
- Alkali metaller kadar aktif değildir.
- Ametallerle iyonik bağlı bileşik oluşturur.
- Bileşiklerinde +2 değerlik alırlar.
- Diğer özellikleri metallerle aynıdır.
3A Grubu (Toprak Metaller)
- Bor hariç hepsi metaldir.
- Elektron dağılımları p1 ile biter.
- Ametallerle iyonik bağlı bileşik oluşturur.
- Bileşiklerinde +3 değerlik alırlar.
- Diğer özellikleri metallerle aynıdır.

7A Grubu (Halojenler)
- Elektron dağılımları p5 ile biter.
- En aktif ametal grubudur.
- Bileşiklerinde değişken değerlikler alabilirler.
- Kararlı hallerinde –1, bazı bileşiklerinde –1 … +7 arasında değerlik alırlar. Flor atomu(F) sadece –1 değerlik alır.
- Doğada moleküler halde bulunurlar. (F2, Cl2.. gibi)
- Isı ve elektriği iletmezler.
- Oda koşullarında katı, sıvı veya gaz halde olabilirler.Oda sıcaklığında Cl2 gaz, Br2 sıvı, I2 katı haldedir.
- Birden fazla oksijenli oksitleri asidik özellik gösterir.
- Kendi aralarında veya diğer ametallerle kovalent bağ oluşturur.
[m2]

8A Grubu (Soygazlar)
- Elektron dağılımları p6 ile biter.
- Oda koşullarında hepsi gaz halde bulunur.
- Bileşik oluşturamaz, kararlı yapıdadır.
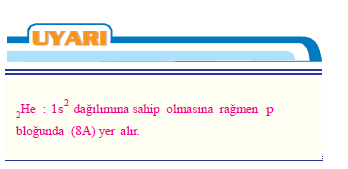
- Helyum (2He) hariç hepsinin son yörüngesinde 8 elektronu bulunur.
Geçiş Metalleri (B grupları)
- Elektron dağılımları d ile biter
- Hepsi metaldir.
- Bileşiklerinde birden fazla (+) değerlik alır
- Ametallerle iyonik bağlı bileşik oluşturur.
Periyot ve Grup Bulma
Nötr bir atomda temel hal elektron dizilişinde en yüksek başkuant sayısı periyot numarasını verir. En yüksek baş- kuant sayısının sahip olduğu toplam elektron sayısı (değerlik elektron sayısı = des) da grup numarasını verir. Elementin son orbitali, s veya p ile bitiyorsa Æ A grubu elementi d ile bitiyorsa Æ B grubu elementi f ile bitiyorsa Æ İç geçiş elementi(Lantanit veya aktinit) dir.
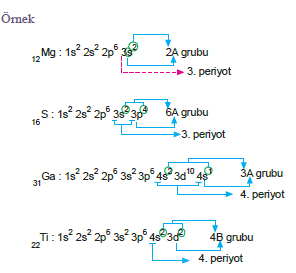
tablosu verilebilir.
- Bir elementin temel hal elektron dizilişinden o elementle ilgili,
– Periyodik cetveldeki yeri
– Blok türü
– Metal ya da ametal karakteri
– Değerlik orbitallerinin türü
– Değerlik elektron sayısı (des)
gibi sonuçlara ulaşılabilir.
ÖRNEK: Bir elementle ilgili aşağıdaki bilgilerden hangisine ulaşabilmek için, o elementin temel haldeki atomları- nın elektron dağılımının bilinmesi yeterli değildir?
A) Kütle numarası B) Atom numarası C) Değerlik D) Grup numarası E) Periyot numarası
1999 ÖSS
ÇÖZÜM: Bir elementin temel haldeki atomunun elektron dizilişi bilinirse o elementin,
– Nötr atomunun elektron sayısı (atom numarası)
– Periyot ve grup numarası
– Değerlik elektron sayısı
belirlenebilir. Ancak nötron sayısı ve kütle numarası bilinemez.
Yanıt A
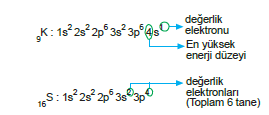
A grubu elementleri için aşağıdaki eşitlik yazılabilir.
- Değerlik elektronları sayısı = Grup numarası
- Son orbitali d ile biten elementler için değerlik elektronları sayısı, grup numarasına eşittir diyemeyiz


[kimya_ygs_lys]

Çok güzel olmuş…
yardımlarınız için teşekür ederim.ödevim yaptım
çok teşekkürler çok yardımcı oldunuz
Çok iyi
Ödevimi çok kolay bir şekilde tamamladım teşekkürler.
Cook teşekkürler cok yardımcı oldunuz
eyvallah Sağolun ödevi yaptim
hiç iyi değil
Süper. Çok teşekkürler. 🙂
Cok saol ya kimya da bitti 🙂
çok teşekkürler çok yardımcı oldunuz
uf ya hiç iyi değil bütün siteleri gezdim ödevimin cevabı yok ya 🙂 😀
çok güzel bence herkese tavsiye ederim 😀
sagolun ödevi yapabildim
neden 4a grubu yok
Ben beğendim doğrusu
çok güzel olmuş ellerinize saglık
istedigımı bulamadım ama guzel sıte kulanıslı ben bır tek grup ozellıklerıne baktım vardı ama ıstedıgım sey yoktu
çok güzel
Neden B gruplarının özellikleri yok ?